Versons un peu de chlorure de sodium solide (constituant majoritaire du sel de cuisine) dans un cristallisoir contenant un litre d'eau. Agiter.
Qu'observe-t-on?
Au départ, on oberve la dissolution du solide dans l'eau puis à partir d'une certaine masse de solide versé (358g à 20°C), la dissolution n'est plus possible. La solution est dite saturée.
La dissolution du solide ionique implique dans la première phase, une destruction du solide cristallin en ses ions sodium Na+et ses ions chlorure Cl- . Les ions sont solvatés et dispersés dans l'eau. Le solvant (l'eau) est donc ionisant et dispersant. L'ajout de solide provoquera la saturation de la solution en sel et on constate qu'un équilibre entre les trois espèces chimiques s'est établi:
NaCl(s) = Na+(aq) + Cl-(aq)
On observe le même phénomène avec tous les solides ioniques.
Par exemple, le carbonate de calcium : 0,014g/L d'eau à 20°C.
On définit la solubilité dans l'eau d'un solide comme la quantité de matière de solide que l'on peut dissoudre dans un litre d'eau.
Ainsi, la solubilité du chlorure de sodium à 20°C est s = 358g.L-1.
NaCl(s) est un sel dit "soluble" car dans l'hypothèse des solutions diluées, sa limite de solubilité n'est pas atteinte. Les solutions diluées de chlorure de sodium ne sont donc pas, en général, saturées.
En revanche, AgCl(s) est un sel dit "peu soluble" car sa limite de solubilité est vite atteinte. La solution obtenue sera saturée.
On peut appliquer comme pour tout équilibre chimique, la loi d'action de masse de Guldberg et Waage.
Prenons l'exemple de l'équilibre entre l'hydroxyde de cuivre (II) solide et les ions hydroxydes et les ions cuivre (II):
Cu(OH)2 (s) = Cu2+(aq) + 2 HO-(aq) (équation (a))
La constante d'équilibre s'écrit :
Ks = [Cu2+]eq.[HO-]eq2
Cette constante est appelée "produit de solubilité de l'hydroxyde de cuivre (II)"
On rappelle que Ks (comme les constantes d'équilibre vues précédemment) n'a pas d'unité et elle ne dépend que de la température.
Connaissant la solubilité s d'un solide, on peut en déduire son produit de solubilité.
En effet, la solubilité de ce solide est : s(Cu(OH)2) = 1,7x10-7mol.L-1
or [HO-]=2 [Cu2+] d'après l'équation chimique (a).
donc si on peut dissoudre 1,7x10-7mol de solide dans un litre d'eau, on a 1,7x10-7mol d'ions Cu2+ en solution et 2x(1,7x10-7)mol d'ions HO-.
Soit Ks= [Cu2+]eq.[HO-]eq2 = sx(2s)2 = 4s3
Numériquement : Ks = 4x(1,7x10-7)3 = 2x10-20
Prenons l'équilibre entre l'iodure d'argent solide et ses ions:
AgI(s) = Ag+(aq) + I-(aq)
Soit Ks = [Ag+]eq.[I-]eq
En général, la dissolution d'un solide est endothermique.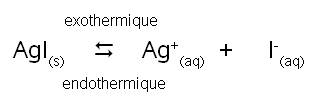
Une augmentation de température favorise la réaction endothermique, on favorise donc l'ionisation. Le solide sera donc plus soluble à chaud.
En général, Ks augmente avec la température.
Il existe toutefois quelques exceptions (bromure d'argent...).
Remarque : il existe d'autres moyens pour déplacer l'équilibre de précipitation :
par effet d'ion commun : si on ajoute des ions Ag+ (ou I-) dans le milieu, le système tendra à les consommer en favorisant la précipitation. La solubilité d'un composé ionique peu soluble diminue par introduction d'un ion commun.
On verse goutte à goutte une solution contenant des ions Ag+ à une solution contenant des ions Cl-. Au début, on n'observe rien puis au bout d'un certain nombre de gouttes, il apparaît un précipité blanc de chlorure d'argent (qui noircit à la lumière).
En fait, tant que le produit [Ag+].[Cl-] < [Ag+]eq.[Cl-]eq = Ks , on n'oberve pas de précipitation. (solution insaturée)
On observe la précipitation du solide lorsque [Ag+].[Cl-] = [Ag+]eq.[Cl-]eq = Ks. (solution saturée)
Autre exemple : pour le phosphate de calcium Ca3(PO4)2, on aura précipitation lorsque:
[Ca2+]3.[PO4]2 = Ks (Ca3(PO4)2)